应选择具有已知分析物浓度的标准样品,以涵盖从检测下限到上限(校准)的整个测定范围。这是为了确保无论样品中可测量的分析物浓度较低还是较高,测定的灵敏度和精确度都是一致的。此外,患者样本应取自并包含各种年龄范围、种族、性别和健康状况,以确保检测的广泛适用性和可靠的结果。在定量之前和定量过程中保持目标分析物稳定对于准确测定浓度至关重要。因此,样品提取、制备和储存中涉及的以下分析前条件尤其重要。
必须选择能够保持分析物稳定性的适当样品基质。
可能需要将蛋白酶抑制剂添加到生物流体样品基质中,以防止天然存在的蛋白酶降解分析物。
收集患者样本时,必须评估运动、禁食、酒精、烟草和季节变化的影响。
必须确定最佳样品储存温度(-80° C、-20° C、2-8° C 或室温)和冻融循环次数
必须研究样品在室温下放置并在检测环境中保持稳定的时间长度。
移液前必须以标准化方式充分混合或倒置样品,以确保分析物在整个样品基质中均匀分布。
洗涤缓冲液的目的是洗掉任何未结合或过量的物质,否则可能会产生背景噪音信号并干扰测定和结果。洗涤缓冲液的设计具有与生理条件相似的 pH 值和盐浓度,并含有TRIS ( FT15751 )、PBS 和聚山梨酯等洗涤剂。如果检测到大量“背景噪音"而不是信号强度,则增加洗涤缓冲液的体积、洗涤剂的浓度或/和洗涤步骤的数量通常会有所帮助。这将增加所有未结合材料被去除的可能性。如果怀疑分析物降解或者分析物在程序中被洗掉,则减少洗涤步骤数、洗涤缓冲液体积或缓冲液中去污剂的浓度可能是有益的。
为了防止与其他检测成分发生交叉反应和非特异性抗原结合,需要使用封闭剂。通常将牛奶溶液(脱脂奶粉)、全血清或牛血清白蛋白 (BSA) ( PRO-422 ) 等试剂添加到缓冲液中,并在第一次洗涤步骤后使用,以饱和孔的自由表面。
这种封闭缓冲液也可以含有去污剂,但应避免使用可能干扰测定的生物素或免疫球蛋白等成分。总体封闭缓冲液可以获得更高的信噪比,并且可以在使用的封闭剂的体积、浓度和类型方面进行优化。
常用的信号系统之一是酶联抗体,并且有多种不同形式和物种类型可供选择。常用于 ELISA,其中碱性磷酸酶和磷酸对硝基苯酯底物在目标分析物存在的情况下会产生黄色。检测抗体还可以与过氧化物酶并与氨基水杨酸和邻苯二胺底物一起使用,如果出现阳性结果,它们会呈现棕色。总体酶反应用于证明反应的特异性和速率。信号出现后,可以添加氢氧化钠、盐酸或硫酸来终止反应。
在测定开发过程中,性能和财务方面在确定应使用哪些试剂以及浓度时起着关键作用。虽然使用较低浓度的酶联抗体可能更具成本效益,但可能有必要增加浓度以确保产生足够的信号强度。如果您的 ELISA 灵敏度较差,可以通过改变抗体类型(从单克隆抗体到多克隆抗体)或采用不同的信号系统来放大信号。第一个例子是二抗被生物素化,然后添加链霉亲和素-HRP。由于四个链霉亲和素分子可以与生物素相互作用,因此通过添加更多的链霉亲和素分子进行检测,可以提高检测少量分析物的能力。此外,通过用多种酶、银纳米颗粒标记检测抗体或使用化学发光或荧光底物等替代底物类型,可以提高灵敏度。
标准曲线或校准曲线由分布在测定范围内的已知分析物浓度的样品组成。它们在 ELISA 中用作辅助,以便稍后计算目标分子的浓度。应该强调的是,校准品和对照品的矩阵应尽可能与所运行的天然样品的矩阵相似。
运行标准曲线很有用,如果生成的标准曲线较差,可能会导致结果无效或突出检测中的错误。不正确的抗体结合或分析物捕获可能是标准曲线不良的原因。除了校准曲线外,还应使用阳性和阴性对照样品。阴性对照不应包含任何感兴趣分析物的痕迹,因为它们用于检查假阳性和非特异性结合。阳性对照应含有已知浓度的目标分析物。如果测定检测到阳性对照中存在分析物并且阴性对照均为阴性,则测定工作可靠且结果有效。
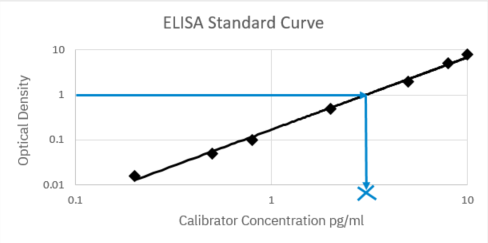
使用已知浓度的校准品创建的 ELISA 标准曲线示例,X 表明通过曲线插值获得的未知样品的浓度。
尝试并使用 ELISA 的特定孵育时间和温度,有助于在捕获抗体和目标分析物之间达到结合平衡。控制板周围温度的一种方法是使用确保波动最小的培养箱。此外,使用混合器可以帮助您的 ELISA 达到最佳性能,因为它有助于将试剂分布在整个基质中,以促进更多的结合。一般来说,较长的潜伏期可能有利于灵敏度,因为有更多的时间进行结合。然而,还应该测试缩短的孵育时间。
当捕获抗体固定到 ELISA 板上时,其方向可能会发生变化,从而降低其亲和力以及与抗原结合的机会。此外,洗涤步骤中抗体的置换可能导致灵敏度和重现性较差。解决这个问题的一种方法是使用单层表面,使抗体能够共价结合到板上,但 Tania García-Maceira 等人已经证明了灵敏度的更大改进。 (2020)通过使用甲壳素涂层的聚苯乙烯表面来实现。使用这种固定形式,抗体通过与几丁质结合域融合,以更好的方向被捕获到微量滴定板上。
 扫一扫,关注微信
扫一扫,关注微信