蛋白质是由排列成线性链的氨基酸组成的大型有机化合物,并通过相邻氨基酸残基的羧基和氨基之间的肽键连接在一起。蛋白质中的氨基酸序列由基因定义,并由遗传密码编码。虽然这种遗传密码规定了20种“标准"氨基酸,但蛋白质中的残基经常在翻译后修饰中发生化学改变:要么在蛋白质可以在细胞中发挥功能之前,要么作为控制机制的一部分。蛋白质也可以一起工作以实现特定的功能,并且它们经常联合形成稳定的复合物。
像多糖和核酸等其他生物大分子一样,蛋白质是生物体的重要组成部分,参与细胞内的每一个过程。许多蛋白质是催化生化反应的酶,对新陈代谢至关重要。蛋白质也具有结构或机械功能,如肌肉中的肌动蛋白和肌球蛋白,以及细胞骨架中的蛋白质,它们形成了维持细胞形状的支架系统。其他蛋白质在细胞信号传导、免疫反应、细胞粘附和细胞周期中也很重要。蛋白质也是我们饮食中的一部分,因为动物不能合成所有的氨基酸,必须从食物中获取必需氨基酸。通过消化过程,动物将摄入的蛋白质分解成可用于蛋白质合成的游离氨基酸。
蛋白质一词来自希腊语“prota ",意思是“最重要的",瑞典化学家琼斯·雅可比·贝采里乌斯在1838年描述并命名了这些分子。然而,直到1926年詹姆斯·B·萨姆纳发现脲酶是一种蛋白质,蛋白质在生物体内的中心作用才被充分认识。[1]第一个被测序的蛋白质是胰岛素,由弗雷德里克·桑格完成,他因此获得了1958年的诺贝尔奖。1958年,马克斯·佩鲁茨和约翰·考德里·肯德鲁爵士首先解决了血红蛋白和肌红蛋白的蛋白质结构问题。[2][3]两种蛋白质的三维结构都是通过x射线衍射分析并确定的;肌红蛋白和血红蛋白的结构为他们的发现者赢得了1962年诺贝尔化学奖。
蛋白质是由20种不同的L-α-氨基酸构成的线性聚合物。所有的氨基酸都有共同的结构特征,包括一个α碳,一个氨基,一个羧基和一个可变侧链。只有脯氨酸不同于这种基本结构,因为它在N-端胺基上含有一个不寻常的环,这迫使CO-NH酰胺部分进入固定的构象。[4]标准氨基酸列表中详细列出的标准氨基酸的侧链具有不同的化学性质,这些化学性质产生蛋白质的三维结构,因此对蛋白质的功能至关重要。多肽链中的氨基酸通过脱水反应中形成的肽键连接。一旦连接在蛋白质链上,单个的氨基酸被称为残基,连接的一系列碳、氮和氧原子被称为主链或蛋白质骨架。肽键有两种共振形式,这两种共振形式有助于一些双键特征并抑制围绕其轴的旋转,因此α碳大致共面。肽键的另外两个二面角决定了蛋白质骨架的局部形状。
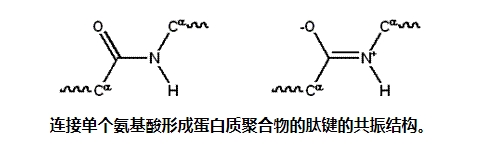
由于单个氨基酸的化学结构,蛋白质链具有方向性。蛋白质带有游离羧基的末端称为C末端或羧基末端,而带有游离氨基的末端称为N末端或氨基末端。
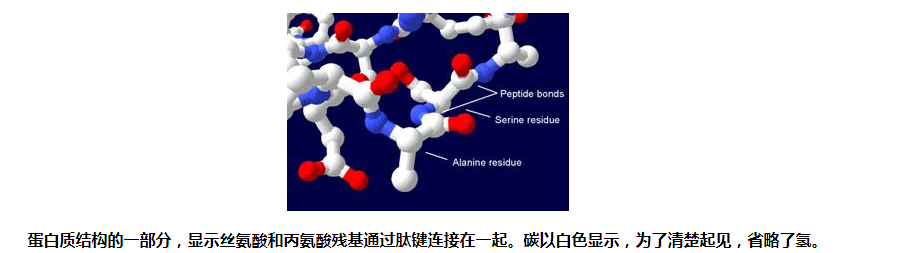
蛋白质、多肽和肽这几个词有点模糊,意思可能会重叠。蛋白质通常是指处于稳定构象的完整生物分子,而肽通常是指缺乏稳定三维结构的短氨基酸寡聚体。然而,两者之间的界限不明确,通常位于20-36个残基附近。[5]多肽可以指任何单个线性氨基酸链,通常不考虑长度,但通常意味着缺乏单一确定的构象。


 扫一扫,关注微信
扫一扫,关注微信