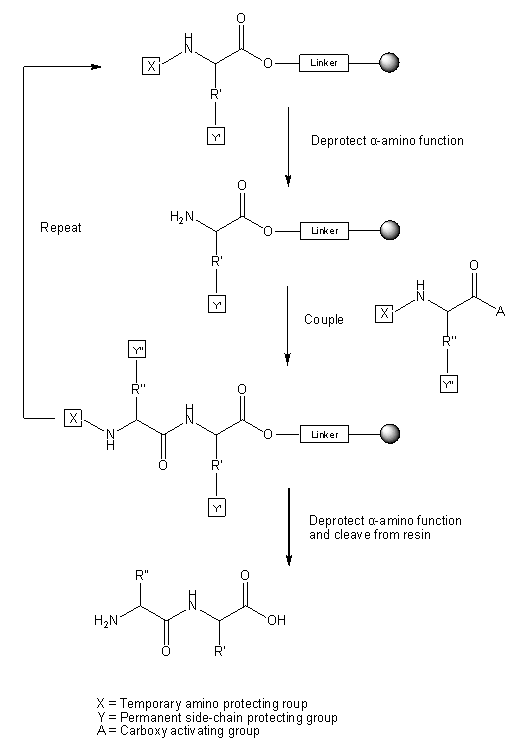
8.固相肽合成的一个例子
以下是使用碱不稳定的9-芴基甲氧基羰基(Fmoc)保护基团在聚酰胺或聚苯乙烯树脂上合成肽的合成步骤的概述。使用下面概述的技术,将获得在N-末端用乙酰基封端,在C-末端用伯酰胺(CONH2)封端的肽。
为手动肽合成设置玻璃器皿
手动肽合成可以在具有三通阀的烧结过滤器反应容器中完成,该三通阀通过1孔塞子安装在1 L侧臂真空烧瓶上。一个阀门用于充入氮气,氮气首先通过一个小的Drierite柱,然后进入反应混合物以搅拌溶液和混合试剂。另一个阀门用于排空过量的反应溶液,并使用真空瓶洗涤溶剂。用于固相合成的所有玻璃片应在使用前用硅烷化试剂(如DCM中的1-5%二甲基二氯硅烷)处理,以避免静电荷的积累,静电荷的积累会使树脂很难处理。
聚酰胺树脂的制备
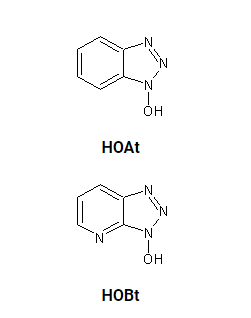
聚酰胺(PL-DMA)树脂(1g)用乙二胺(40 ml)在50 ml Falcon管中在摇床上处理过夜,然后过滤,用5×10ml 1:1二甲基甲酰胺(DMF):二氯甲烷(DCM)溶液、5×10ml 1:1 DCM洗涤,并使用苯并三唑-1-基-氧基三吡咯烷六氟磷酸盐(PyBOP) (3 eq)、1-羟基苯并三唑水合物(HOBt) (3 eq)和二异丙基乙胺(DIPEA)装载Fmoc-Rink然后可以在真空下干燥,并储存在-15摄氏度,直到需要。
在合成前和合成过程中处理树脂
树脂首先在10毫升1∶1 DCM∶DMF中溶胀15分钟,然后沥干。每次完成氨基酸偶联后,还用5×10ml 1:1 DCM和DMF洗涤树脂。
Fmoc-去保护
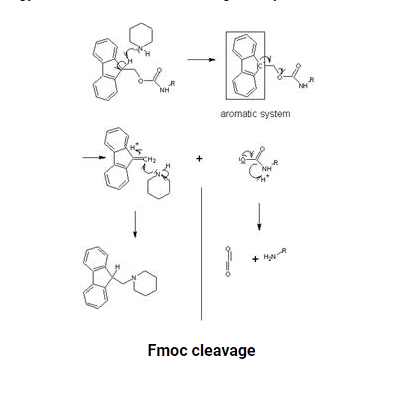
每次氨基酸偶联后,用2×10ml 20%哌啶的DMF溶液进行Fmoc去保护,每次处理用N2搅拌10分钟。然后用5×10毫升DMF洗涤树脂,接着用5×10毫升1:1 DCM:DMF洗涤。
添加氨基酸
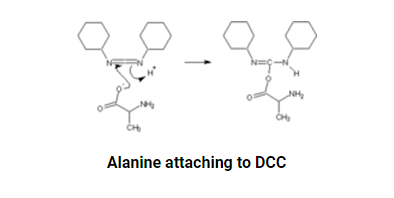
为了在Fmoc-聚酰胺-Rink树脂上开始肽合成,通过用哌啶处理树脂来除去Fmoc基团。然后使用在1∶1 DCM∶DMF中的PyBOP (3 eq)、HOBt (3 eq)和DIPEA (6 eq)将第一个氨基酸偶联至树脂的Fmoc-去保护的N-末端胺,或之前偶联的氨基酸,直到树脂对茚三酮呈阴性。
监测氨基酸偶联的进展
氨基酸偶联的过程可以用茚三酮或对氯醌来跟踪。茚三酮溶液在游离伯胺的存在下变成深蓝色(阳性结果),但在其他情况下是无色的(阴性结果)。如果使用乙醛作为溶剂,在伯胺的存在下,或者如果使用丙酮,在仲胺的存在下,对-氯醌溶液将使树脂珠变成深黑色或蓝色;否则珠子保持无色或淡黄色。(测试概述如下)
茚三酮测试(1)
向微量离心管中加入2滴40%苯酚的乙醇溶液、2滴0.014 M KCN的吡啶溶液和4滴5%茚三酮的乙醇溶液,以及抹刀一端大小的树脂样品,然后涡旋混合物,并在100°c下加热5分钟
用氯醌测试(2)
向微量离心管中加入5滴丙酮或乙醛、5滴对氯醌的甲苯饱和溶液,以及小刮刀一端大小的树脂样品,然后涡旋混合物,并在室温下静置5分钟。丙酮用于检测仲胺,乙醛用于检测伯胺。
持续肽延伸
一旦氨基酸的偶联完成,就洗涤树脂,用哌啶去保护Fmoc基团,并再次洗涤树脂,为下一次偶联做准备。重复这一过程,直到添加完所有必需的氨基酸。
乙酰化N-末端
肽序列完成后,可以用2ml 1:1乙酸酐和三乙胺在10ml 1:1 DCM:DMF中乙酰化N-末端胺1小时或直到茚三酮阴性,然后用5×10ml 1:1 DCM:DMF洗涤树脂,然后将肽从树脂上切下。如果需要,N-末端也可以作为游离胺留下。
从树脂上切割肽
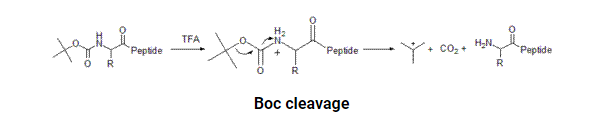
用3×10ml 96∶2∶2的TFA、三异丙基硅烷(TIPS)和水(H2O)处理树脂,每次处理10分钟,然后过滤掉树脂,将合并的滤液静置1小时,以确保除去酸不稳定的保护基团。
从树脂上切割后肽的处理
将TFA在旋转蒸发器上蒸发至干(或重油或玻璃,如果它不凝固的话),随后向烧瓶中加入5 ml*醚以沉淀肽,并除去大部分副产物。将肽和乙*的悬浮混合物加入到50 ml Falcon管中,并以3000 rpm的速度旋转10-20分钟(IEC离心机),直到可以倒出乙*而不损失任何肽。加入更多的后,通过涡旋使肽重新悬浮。再次离心混合物,倒出,洗涤过程重复两次以上。最后,产品可以在脱粘器中的Falcon管中风干过夜。
通常使用制备型HPLC来纯化最终产物。获得质谱数据以确保获得目标肽。
 扫一扫,关注微信
扫一扫,关注微信