(L-丙氨酸:2氧代戊二酸氨基转移酶;2.6.1.2谷丙转氨酶(GPT)也称为丙氨酸氨基转移酶。它催化以下反应:GPT L-丙氨酸+α-酮戊二酸-》丙酮酸+L-谷氨酸转氨反应在中间代谢中起重要作用。转氨酶的催化活性需要磷酸吡哆醛作为辅酶。GPT存在于许多动植物组织中,在哺乳动物的心脏和肝脏中活性尤其高。这种酶在哺乳动物组织中以两种不同的同工酶形式存在,线粒体形式和细胞质形式。来自猪心的GPT已被广泛研究。它的分子量为10万。
在pH 7.5和25℃的磷酸钾缓冲液中,催化1微摩尔α-酮戊二酸转化为L-谷氨酸的酶量
由NADH氧化引起的340 nm处吸光度的降低与GPT的催化活性成正比。
组分:
0.1 M磷酸钾缓冲液,pH 7.5。
缓冲液中的1.15M L-丙氨酸(103毫克/毫升)。
缓冲液中的0.31Mα-酮戊二酸(45毫克/毫升)。
蒸馏水中的0.008 M NADH二钠盐(5毫克/毫升)。准备新鲜的。
乳酸脱氢酶(LDH),缓冲液中250 U/ml。化验前立即准备新鲜样品。
酶(GPT)溶液。在缓冲液中制备,使最终浓度为0.1-0.2 U/ml。必须在化验前立即制备新鲜样品。
PROCEDURE
将分光光度计(配有条形记录仪和温度控制装置)设置在340 nm和25°c。
2.向比色皿移液管中加入所示量的以下试剂: 左旋丙氨酸2.60毫升 α-酮戊二酸盐0.10毫升 NADH 0.10毫升 乳酸脱氢酶0.10毫升 混合并在分光光度计中孵育5分钟以达到温度平衡,然后记录340 nm处的空白率。
3.通过向比色皿中加入0.1毫升酶(GPT)溶液来启动反应。
4.记录5-8分钟内340 nm处吸光度的下降率。
5.计算(delta)E340nm纳米/分钟
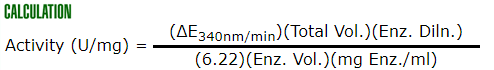
 扫一扫,关注微信
扫一扫,关注微信